Wie Viel Wiegt Ein Elektron
Chemie
Was ist die atomare Masseneinheit u ?

Inhaltsverzeichnis:
In diesem Text möchten wir dir erklären, woher die Bezeichnung der atomaren Masseneinheit $u$ kommt und was homo darunter zu verstehen hat.
Unter dem Begriff der Atommasse fasst man die Masse von Atomen der chemischen Elemente zusammen. Diese Masse setzt sich aus der Anzahl und dem Gewicht der Protonen und Neutronen, die sich im Kern eines Atoms befinden, zusammen. Die Elektronenhülle eines Atoms spielt bei der Zusammensetzung der Masse keine Rolle.
Beispiel
Beispiel
Hier klicken zum Ausklappen
Im Kern eines Sauerstoffatoms (O) befinden sich acht Protonen und acht Neutronen. Zusammen ergeben sie dice Gesamtmasse des Atoms.
Nun möchten wir dir zeigen, wie viel ein solches Atom genau wiegt. Dafür musst du wissen, dass die Elektronen, dice sich in der Hülle des Atoms befinden, nahezu keine Masse haben. Sie machen lediglich 0,1 % der Gesamtmasse aus. Dieser Wert ist in absoluten Zahlen sehr gering, daher kannst du ihn für deine Rechnungen vernachlässigen.
Die Einheit für die Masse eines Atoms wird mit $u$ abgekürzt. Diese leitet sich von dem englischen Begriff $unit$ (engl. Einheit) ab. Ein $u$ entspricht der Masse von $0,000 000 000 000 000 000 000 001 66054g$ $=$ $1,66054*ten^{-24}m$.
Jedes Proton oder Neutron ist jeweils $1u$ schwer. Demnach ergibt die Summe der Neutronen und Protonen, die sich im Kern eines Atoms befinden, die Masse des Atoms, die in $u$ angegeben wird. Würdest du nun diese atomare Masseneinheit $u$ mit dem oben genannten Gewicht multiplizieren, so würdest du das exakte Gewicht eines Atoms in Gramm erhalten.
Atomare Masse des Sauerstoffs
Schauen wir uns das nun am Beispiel eines Sauerstoffatoms an. Ein Sauerstoffatom hat in seinem Kern acht Protonen und acht Neutronen. Das bedeutet, dass sich 16 Teilchen in diesem Kern befinden, die jeweils die Masse $1u$ besitzen. Demnach beträgt dice atomare Masse eines Sauerstoffatoms $16u$. Dies entspricht einer Masse von $0,000 000 000 000 000 000 000 026 568g$ $=$ $2,65686*10^{-23}grand$.
Du siehst, dass diese Zahl sehr unhandlich ist, daher verwendet man für die Masse eines Atoms der Einfachheit halber den Wert $16u$.
Das Periodensystem
Da jedes Element eine unterschiedliche Anzahl von Protonen und Neutronen besitzt, sind die Elemente auch unterschiedlich schwer. Nach ihrer Masse sind diese Elemente dann geordnet worden. Du kennst diese Ordnung als Period System of Elements (PSE) oder als Periodensystem. Dabei werden dice Elemente von leicht nach schwer geordnet. Im Anschluss wurde diese Reihenfolge durchnummeriert. Maßgeblich für diese Ordnung state of war die Kernladungszahl der jeweiligen Atome, die sich mit der Zahl der Protonen deckt.
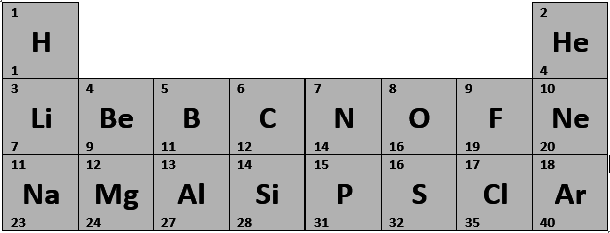
Periodensystem der Elemente
Aus dieser Nummerierung ergibt sich dice Ordnungszahl für jedes Element, die du oben in der Grafik sehen kannst (1, 2, three, 4 usw.). Oben links findest du in der Abbildung jeweils die Anzahl der Protonen und unten links dice Masse. Daraus kannst du dir ableiten, dass, je größer die Ordnungszahl ist, dice Masse des Atoms auch größer ist. Die Zahlen sind jedoch nicht willkürlich und ohne Bezug zum Aufbau des Atoms gewählt. Die Ordnungszahl der einzelnen Elemente zeigt dir außerdem, wie viele Protonen sich im Kern des Atoms befinden.
Beispiel
Beispiel
Hier klicken zum Ausklappen
Aluminium (Al) trägt dice Ordnungszahl thirteen. Daher weißt du, dass sich thirteen Protonen im Kern befinden.
Wenn du nun zu dieser Zahl noch die Anzahl der Neutronen addierst, erhältst du die Masse des gesamten Atoms. Im Falle unseres Beispiels sind das 14 Neutronen. Demnach befinden sich 27 Teilchen im Kern, die jeweils $1u$ wiegen. Dice atomare Masse von Aluminium beträgt somit $27u$.
Jetzt weißt du, warum in der Chemie die atomare Masseneinheit $u$ verwendet wird und was sich hinter dieser Abkürzung verbirgt. Dein Wissen darüber und über dice Struktur des Periodensystems der Elemente kannst du nun in unseren Übungen überprüfen. Wir wünschen dir viel Spaß und Erfolg dabei.
Source: https://www.studienkreis.de/chemie/atomare-masseneinheit-u/

0 Response to "Wie Viel Wiegt Ein Elektron"
Post a Comment